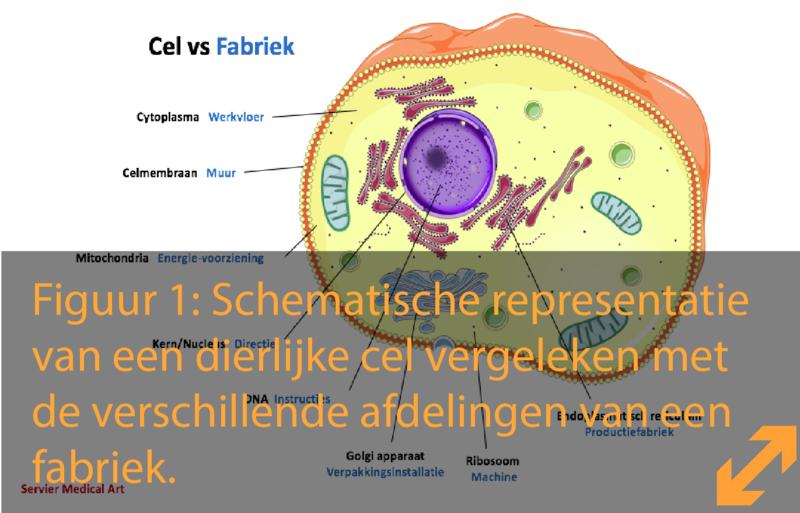
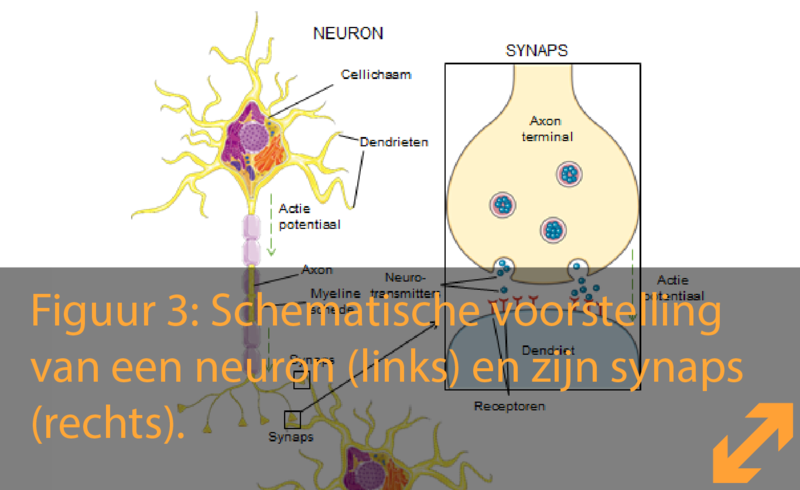
Waarom deze pagina
Onze webpagina vormt een platform dat licht werpt op de diverse functies van de hersenbarrières en tegelijk informatie verschaft over onderzoeksprojecten in dit veld. Onze webpagina is in continue ontwikkeling. Indien de inhoud van deze pagina specifieke vragen oproept, of u meer informatie behoeft over een specifiek onderwerp, wees dan welkom om contact op te nemen met het BtRAIN team!
Ons doel is om de huidige kennis over hersenbarrières te vergroten en op deze manier een stap dichter te komen tot het helpen van patiënten die aan hersenziekten lijden. Deze webpagina, BrainBarriers4You, is opgericht om geïnteresseerden een inleiding te geven over de hersenbarrières en een blik te werpen op de verschillende projecten die wij binnen ons BtRAIN netwerk uitoefenen.
Inleiding
Hersenbarrières
Brain Barrier Introduction
Onze hersenen vormen een zeer belangrijk orgaan en dienen zodoende goed te worden beschermd. Hiervoor beschikt de mens over hersenbarrières, vergelijkbaar met de muren van een kasteel. Deze barrières bieden enerzijds bescherming tegen gevaarlijke stoffen, net als de kasteelmuren indringers buiten houden, en tegelijkertijd zorgen zij voor het selectief doorlaten van noodzakelijke voedingsstoffen en de uitscheiding van afvalstoffen. Wanneer deze hersenbarrières niet correct werken, heeft dit drastische gevolgen voor het functioneren van de hersenen waardoor deze mogelijk aangetast worden en we bijgevolg ziek kunnen worden. Het komt ook voor dat de hersenen zelf een aandoening hebben die medicatie vereist. Dit vormt echter een probleem, want diezelfde hersenbarrières die de hersenen beschermen, voorkomen tevens het binnenkomen van medicatie met als gevolg dat de hersenen de behandeling niet kunnen ontvangen. Het is alsof de bewakers van het kasteel geen onderscheid kunnen maken tussen vijanden en hulpverleners, en zo beide geen toegang verlenen tot het kasteel. Hierdoor zijn hersenaandoeningen zoals de ziekte van Alzheimer (Alzheimer’s disease, AD), multiple sclerose en hersenkanker heel moeilijk te behandelen. Het is derhalve hoogst noodzakelijk dat we meer inzicht creeren in de werking van de hersenbarrières. Alleen op deze manier is het mogelijk om nieuwe medicatie en strategieën te ontwikkelen voor de behandeling van deze ziekten.
Contact
Bezoek de officiele website van het BtRAIN project om in contact te komen met de ESRs of andere leden van het netwerk http://www.btrain-2020.eu/
Waarom hebben wij hersenbarrières
Ons lichaam bestaat uit verschillende organen zoals de lever, de nieren, het hart, de longen, de spieren en de hersenen die allen als een geoliede machine samenwerken om ons te laten ademen, denken, lopen, lachen en dromen, en dit dag in en dag uit. De centrale controleruimte voor dit alles ligt in onze hersenen en ruggenmerg, welke samen het centrale zenuwstelsel (CZS) worden genoemd. Het CZS ontvangt en coördineert al de informatie en prikkels komende van het lichaam en onze omgeving om vervolgens instructies terug te geven naar onze spieren om te bewegen, naar onze longen om te ademen, naar onze ogen om te kijken en naar onze mond om te eten en spreken.
Deze uitwisseling van informatie wordt uitgevoerd door cellen genaamd neuronen. Vergelijkbaar met een internet netwerk vormen deze neuronen kabels welke alle organen en spieren aaneenschakelen aan verschillende controlecentra in de hersenen, en vervolgens vanuit de hersenen weer uitreiken naar het hele lichaam om onze lichaamsfuncties te coördineren.
Voor het correct functioneren van deze neuronen is het essentieel dat de omgeving waarin zij zich bevinden (onze hersenen) constant wordt gehouden zonder grote veranderingen en verstoringen. Het belang hiervan wordt geïllustreerd aan de hand van alcoholintoxicatie. Alcohol is een bijzonder en klein molecuul dat gemakkelijk de hersenbarrières oversteekt.
Wanneer alcohol in de hersenen terecht komt, verandert het de beschikbaarheid van voedingstoffen alsook de stabiliteit van de neuronen, resulterend in de gekende effecten op de mentale toestand van de persoon in kwestie. Stel je voor dat alles wat we eten en drinken zo gemakkelijk tot in de hersenen komt als alcohol. Dit zou betekenen dat we na elk drankje, en na elke lunch we een lange tijd nodig hebben om te herstellen! Het is dan ook noodzakelijk dat onze hersenen afgeschermd zijn van stoffen die onze hersenactiviteit beïnvloeden. Hiernaast dienen onze hersenen ook afgeschermd te worden tegen gevaarlijke organismen, zoals bacteriën, fungi, maar ook virussen die ons hersenweefsel kunnen beschadigen. Zodoende bewerkstelligen de hersenbarrières enerzijds een gecontroleerde opname van voedingsstoffen en tegelijkertijd de blokkade van toxische stoffen en organismen welke de hersenen schade zouden kunnen berokkenen.
Wist je dat?
Alcohol is one of the special molecules that is able to cross the blood brain barrier. This is possible because it is soluble in fat. Another word for fat is lipids. Our cell membranes are formed by a double layer of these lipids similar to a soap-bubble, and are therefore characterized as being ‘lipophilic’ which means ‘to love lipids’.
Most molecules in the bloodstream are only soluble in water and cannot cross the ‘lipophilic’ cell membrane. These molecules are called ‘lipophobic’, meaning ‘fat-fearing’. However, molecules that are lipophilic, such as alcohol, can get into the brain. Another example is opioid painkillers such as tramadol. Luckily, tramadol is lipophilic and therefore can easily reach the central nervous system to decrease our perception of pain. Haloperidol, a classic antipsychotic, is another example of a lipophilic drug.
Lipophilicity versus lipophobicity is thus an important feature to take into account when developing drugs to treat brain diseases. At this moment, we still do not have the knowledge and tools to open the brain barrier in a safe and controlled manner. This is why drug treatment for brain diseases remains limited only to the use of molecules that are lipophilic.
⠀
Dit is waarom we speciale structuren, de hersenbarrières, nodig hebben om de hersenen van de rest van het lichaam te scheiden om, net zoals de muren voor een kasteel, bescherming te bieden tegen de vijand. Deze barrière kan echter niet compleet ondoorlaatbaar zijn omdat de hersenen op deze manier geen voedingsstoffen zouden kunnen ontvangen en zou verhongeren. Daarom verzorgen de barrières enerzijds de bescherming tegen het binnendringen van ongewenste stoffen, terwijl ze anderzijds actieve transporters bevatten voor voedingstoffen en zuurstof vanuit het bloed naar de hersenen. Dit is vergelijkbaar met een kasteel met speciale bewaakte poorten welke kunnen worden geopend zodat boeren hun bevoorrading kunnen binnenbrengen.
Wist je dat?
Zoals in de rest van ons lichaam worden onze cellen in de hersenen oud en gaan ze dood. Ook onze neuronen ondergaan dit proces van celdood. Tijdens de normale veroudering verliezen we neuronen als gevolg van vele natuurlijke processen, maar omdat we over voldoende neuronen beschikken heeft dit geen effect op het functioneren van onze hersenen. Echter kunnen bepaalde ziekten ervoor zorgen dat bovenop de normale celdood extra neuronen sterven. Dit proces wordt ook wel neurodegeneratie genoemd. Dit komt bijvoorbeeld voor in de ziekte van Alzheimer waarbij, door tot nu toe onbekende redenen, ongewenste stoffen zich in de hersenen ophopen waardoor de neuronen sterven. Wanneer er te veel neuronen aangetast worden en afsterven heeft dit een effect op het functioneren van onze hersenen wat kan worden waargenomen in de ziekte van Alzheimer als een progressief geheugenverlies.
Barrières
In ons lichaam
Welke verschillende barrières kunnen we onderscheiden?
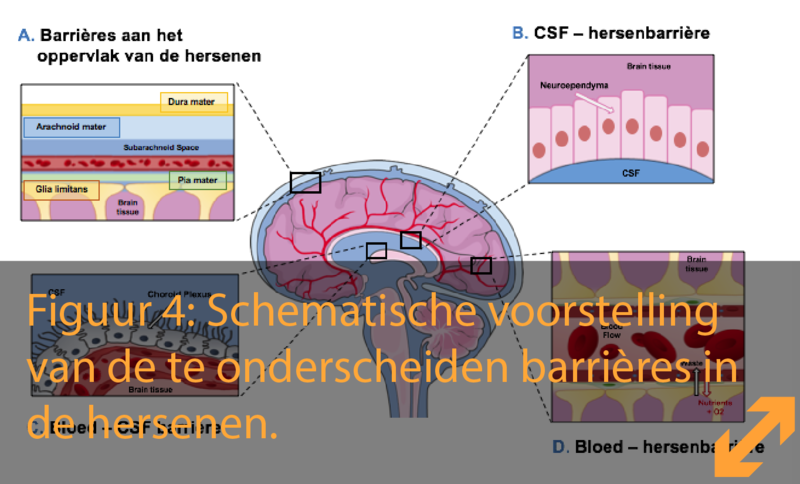
In ons lichaam kunnen we verschillende hersenbarrières onderscheiden (Figuur 4):
- De barrières aan het oppervlak van de hersenen
- De cerebrospinale vloeistof – hersenbarrière (cerebrospinal fluid - brain barrier, CSFB)
- De bloed – cerebrospinale vloeistofbarrière (blood - cerebrospinal fluid barrier, BCSFB)
- De bloed – hersenbarrière (blood-brain barrier, BBB)
- Het raakvlak tussen de cerebrospinale vloeistof en de hersenen
De bloed – hersenbarrière
De bloed – hersenbarrière (BBB) is een barrière die het bloed van de hersenen scheidt.
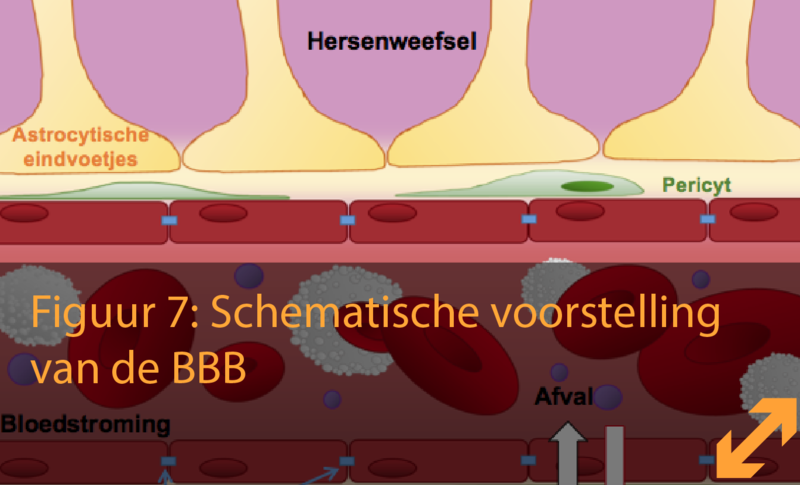
Ons bloed stroomt via een netwerk van bloedvaten naar elk orgaan in ons lichaam om essentiële voedingsstoffen en zuurstof te verspreiden en afvalproducten te verwijderen. De hersenen vormen een dynamisch orgaan dat een evenwichtige omgeving behoeft. Daarom moeten schadelijke stoffen waaronder moleculen zoals toxines, maar ook pathogenen zoals bacteriën of virussen weerhouden worden van toegang tot de hersenen zodat deze geen schade kunnen aanrichten. Deze tweeledige regulatie is mogelijk door de aanwezigheid van de BBB, een hersenbarrière die het bloed van de hersenen scheidt, die bestaat uit een speciale soort van bloedvaten: de haarvaten of capillairen.
Haarvaten zijn de kleinste bloedvaten in de hersenen en bestaan uit duizenden cellen, namelijk endotheelcellen (EC) die elk vlak tegen elkaar zijn geplaatst en op die manier een soort van buizennetwerk vormen. Buiten de EC zijn er ook andere cellen die samenwerken om de kenmerkende BBB-eigenschappen tot stand te brengen. Dit wordt hieronder verder uitgelegd.
Wist je dat?
De haarvaten in de hersenen zijn in totaal zo’n 650 km lang en hebben een totale oppervlakte van 20 m2.
1. Endotheelcellen: De muur van de bloed - hersenbarrière
De endotheelcellen (EC) vormen als het ware de muur van de bloedvaten in ons lichaam. De EC worden gekenmerkt door verschillende eigenschappen die afhankelijk zijn van het orgaan in welke ze voorkomen. Zo zuivert de lever bloed afkomstig van het hart en neemt het de aanwezige bruikbare voedingsstoffen op die afkomstig zijn van onze spijsvertering. De contactpunten tussen de EC, ook wel junctions (= letterlijk ‘knooppunt’) genoemd, zijn derhalve heel open, net zoals een zeef. Hierdoor kan de lever gemakkelijk stoffen opnemen uit het bloed om deze verder te verwerken. In tegenstelling tot de lever zijn deze junctions in de hersenen veel steviger waardoor de EC als het ware strak verzegeld zijn. Deze contactpunten worden dan ook ‘tight junctions’ genoemd.
De hierboven genoemde junctions tussen naburige EC bestaan uit speciale moleculen die celadhesie proteïnen genoemd worden. Deze proteïnen werken als een rits tussen de cellen, en zorgen er zo voor dat de binnenkomst van stoffen tussen 2 naburige cellen op een gecontroleerde manier plaats kan vinden door de rits te openen of sluiten (Figuur 5).
Wist je dat?
Al de informatie die nodig is om complexe en unieke proteïnen te bouwen zit vervat in ons DNA. Dit betekent dat ons DNA heel wat informatie bevat, en wel zoveel dat als we al het DNA dat in onze cellen zit achter elkaar zouden leggen, we de aarde bijna 3 keer zouden kunnen omcirkelen.
Er bestaan verschillende types junctions die de EC als een zipper tegen elkaar doen plakken. Eén van deze types junctions is aanwezig in de EC buiten de hersenen. Ze zorgen ervoor dat de EC als het ware aaneen gelijmd worden zodat het onder andere voorkomt dat rode bloedcellen uit de bloedvaten lekken. Dit type junction wordt de adherens junction genoemd. Een ander type junction dat aanwezig is in de EC van de BBB houdt de cellen extreem strak tegen elkaar. Wanneer naar de EC van de BBB wordt gekeken door middel van een microscoop met sterke vergroting, lijken de cellen heel strak opeen te zitten, vandaar dat deze junctions ‘tight junctions’ genoemd worden. Tight junctions kunnen ook worden teruggevonden in andere weefsels zoals die van de lever en de nieren en beperkt de vrije beweging van moleculen en zouten tussenin de cellen door. Door de aanwezigheid van dit type junctions vormt de BBB een echte fysische barrière die kan vergeleken worden met de muren van een fort. Enkel door speciale transportmechanismen in de EC, kunnen essentiële nutriënten overheen deze barrière getransporteerd worden. Vergelijk de EC met een logistiek bedrijf waarbij vrachtwagens van het bloed naar de EC en van de EC naar de hersenen rijden. Indien nodig kan de cel de specifieke lading van de vrachtwagens ook zelf houden voor eigen gebruik. We kunnen de tight junctions dus beschouwen als een gesloten weg, waarbij het oversteken van de cel strikt wordt gecontroleerd door ‘het logistiek bedrijf’ (Figuur 5).
Wist je dat?
Al de informatie die nodig is om complexe en unieke proteïnen te bouwen zit vervat in ons DNA. Dit betekent dat ons DNA heel wat informatie bevat, en wel zoveel dat als we al het DNA dat in onze cellen zit achter elkaar zouden leggen, we de aarde bijna 3 keer zouden kunnen omcirkelen.
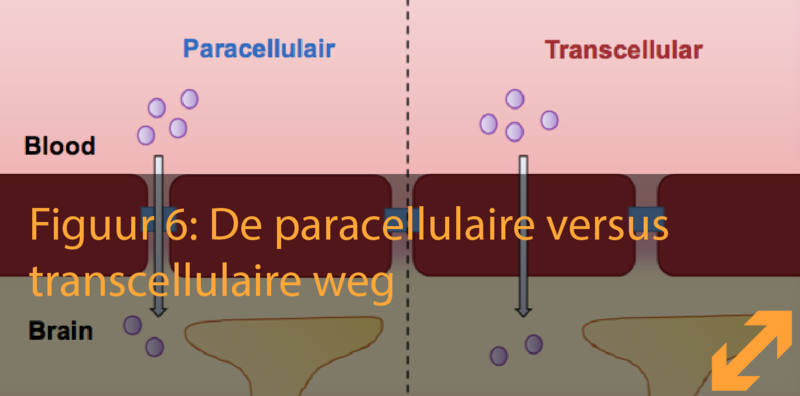
Om de hersenen te bereiken, en dus de BBB te doorkruisen, kunnen moleculen en cellen verschillende wegen gebruiken. Zo kunnen ze een weg nemen tussen 2 celmembranen lang of juist door de celmembranen heen. Deze wegen staan bekend als respectievelijk de paracellulaire en de transcellulaire weg. Het is belangrijk rekening te houden met dit verschil tussen beide wegen wanneer men de doorlaatbaarheid van de barrière en de beweging van moleculen of cellen overheen de BBB bestudeerd.
Wist je dat?
Fysieke oefeningen verbeteren ons geheugen en ons cognitief vermogen. Zo tonen studies aan dat fysieke inspanningen de BBB lichtjes en tijdelijk doen openen. Enkele wetenschappers beargumenteren dat dit ervoor zorgt dat bepaalde factoren zo onze hersenen kunnen binnenkomen en vervolgens de neuronen van ons geheugencentrum stimuleren en doen groeien, waardoor onze hersenen slimmer worden.
2. Pericyten: Een essentiële verpakking
Het woord ‘pericyt’ komt van ‘peri’, hetgeen ‘eromheen’ en ‘cyt’, hetgeen ook wel ‘cel’ betekent. Pericyten zijn een soort van contractiele cellen die de haarvaten gedeeltelijk bedekken door de EC te omvatten zoals klimop met een muur doet (Figuur 6). Op deze manier vervullen de pericyten hun rol in de vormgeving en stabilisatie van de bloedvaten. In de hersenen zijn deze cellen tevens essentieel voor de ontwikkeling en instandhouding van de BBB-eigenschappen van de EC.
Pericyten en EC zijn verbonden met elkaar door een speciale dunne laag tussen beide celtypes, genaamd het basaal membraan. Dit membraan helpt beide cellen met elkaar te verbinden door ze als het ware tegen elkaar te lijmen. Deze nauwe verbinding maakt het mogelijk dat de pericyten de bloedstroming reguleren. Dit gebeurt door enerzijds de bloedvaten te doen vernauwen (vasoconstrictie), vergelijkbaar met een strakke handgreep om een tuinslang, en anderzijds deze grip te verslappen waardoor de diameter toeneemt (vasodilatatie). Deze interactie geeft de pericyten tevens de mogelijkheid om te communiceren met EC om zo de doorlaatbaarheid van deze cellen (ook permeabiliteit genoemd) te reguleren.
Wanneer de pericyten niet deftig werken, kan dit resulteren in een accumulatie van afvalstoffen dat uiteindelijk kan leiden tot het ontstaan of verergeren van ziekten zoals de ziekte van Alzheimer.
3. Astrocyten: Een belangrijke ondersteuning
Astrocyten zijn een speciaal celtype dat onderdeel is van de zogenaamde gliacellen van de hersenen, dewelke de neuronen ondersteuning en bescherming bieden.
De hersenen bestaan uit 2 types cellen namelijk de neuronen en de glia. De term ‘glia’ betekent letterlijk ‘lijmen’ of ‘vullen’ en de naam werd aan deze groep cellen gegeven omdat men eerst dacht dat het hun functie was om simpelweg de hersenen bij elkaar te houden. Gliacellen doen meer dan dat. Ze ondersteunen de neuronen en helpen de omgeving van de hersenen te onderhouden.
Gliacellen kunnen worden onderverdeeld in astrocyten, microglia (de immuun cellen van de hersenen) en oligodendrocyten (welke de myelineschede rond de zenuwen vormen).
Astrocyten zijn sterk vertegenwoordigd en tevens zeer gediversifieerd aanwezig in de hersenen. Astrocyt betekent letterlijk ‘stercel’ vanwege zijn stervormige vorm. Omdat een astrocyt over veel vertakkingen beschikt, kan het zich uitstrekken tot zowel de neuronen als de bloedvaten. De vertakkingen van een astrocyt die naar de bloedvaten reiken eindigen in een specifieke vorm gelijkaardig aan een voet die tot aan het oppervlak van een bloedvat stapt. Hierdoor worden deze uiteinden ook wel de astrocyten eindvoetjes genoemd (Figuur 6). Deze voetjes maken het mogelijk voor de astrocyten om als bemiddelaar te functioneren tussen de neuronen en het bloed. Het is op deze manier dat astrocyten in staat zijn om vasodilatatie (vertraagde bloedstroming) en vasoconstrictie (verhoogde bloedstroming) van de bloedvaten te reguleren, op een gelijkaardige manier als de pericyten. Daarenboven zijn astrocyten essentieel voor het behouden van de structuur van de BBB door de interactie tussen pericyten en EC te regelen en de vorming van tight junctions ter hoogte van de EC te stimuleren.
Wist je dat?
In hersenaandoeningen die gekenmerkt worden met een verlies aan neuronen, zoals de ziekte van Alzheimer of epilepsie, zorgen astrocyten ervoor dat het weefsel zich herstelt. Ze doen dit door in aantal toe te nemen en door van vorm te veranderen. Dit proces gelijkt sterk op het proces waarbij littekens gevormd worden. Hoewel ze het aangetaste weefsel proberen te herstellen, kunnen ze de functie van de neuronen niet overnemen.
De bloed – CSF barrière
Onze hersenen worden zorgvuldig beschermd tegen externe trauma’s zoals klappen. Dit gebeurt niet enkel door de schedel, maar ook door een speciaal hersenvocht die de hersenen omgeeft en dienst doet als een soort van ‘opvangkussen’. Deze vloeistof wordt de cerebrospinale vloeistof (cerebrospinal fluid, CSF) of het hersenvocht genoemd en wordt geproduceerd door een specifieke zone ter hoogte van de 4 hersenventrikels. Deze hersenventrikels liggen verspreid in de hersenen. De hersenvocht-producerende structuur wordt de ‘plexus choroideus’ genoemd (Figuur 4).
De bloedvaten ter hoogte van de plexus choroideus vormen echter geen strakke barrière zoals bij de BBB. Wanneer we deze bloedvaten opnieuw vergelijken met een kasteel, worden de poorten nu niet zorgvuldig bewaakt, maar staan ze continu open zonder dat bewakers de toegang van indringers of goederen controleren. Ter hoogte van de plexus choroideus is er namelijk nog een andere laag van gespecialiseerde cellen, dewelke een dichte barrière vormt, ook wel epitheelcellen of epithelium genoemd. Het epithelium staat in contact met het CSF aan de ene zijde en met het bloed aan de andere zijde en pompt vloeistof en voedingsstoffen van het bloed in het CSF.
Wist je dat?
De menselijke hersenen worden omgeven door ongeveer 150 mL CSF. Omdat deze vloeistof constant wordt vernieuwd, moeten de hersenen elke dag een halve liter van deze vloeistof aanmaken. De productie gebeurt voornamelijk door de plexus choroideus.
Wist je dat?
Een vitale functie van de bloed-CSF barrière is het beschermen van de hersenen tegen infecties. Dit gebeurt door de doorgang van gespecialiseerde cellen uit het bloed te reguleren. Deze cellen worden de immuun cellen genoemd. Immuun cellen kunnen vergeleken worden met soldaten. Ze bestrijden de vijand, normaliter in dit geval infecties en cellen die abnormaal gedrag vertonen, zoals bijvoorbeeld kankercellen. Het belang de patrouillering en interventie van deze immuun cellen wordt duidelijk bij infecties in de hersenen: helaas kunnen sommige virussen en bacteriën de hersenen bereiken via de plexus choroideus en kunnen ze bijgevolg de hersenen aanvallen. Wanneer het leger van immuun cellen er niet in slaagt deze pathogenen te stoppen en vernietigen, kunnen deze de hersenen infecteren en een hersenvliesontsteking veroorzaken.
Ter hoogte van de bloed-CSF barrière vindt er dus ook een enorme controle plaats van de binnenkomst van immuun cellen en deze controle is zeer belangrijk, ook voor een gezond brein. Bij patiënten lijdend aan multiple sclerose (MS) is er een foutieve werking van het leger van immuun cellen. Deze zien goede cellen als slechte cellen, en signaleren vervolgens voor versterking middels het verzenden van geactiveerde immuun moleculen. Bijgevold wordt een kettingreactie in gang gezet waardoor nog meer immuun cellen naar de hersenen uitrukken. Dit ‘zelf-aanval-phenomeen’ noemt men ook wel een auto-immuunziekte (‘Auto’ staat hier gelijk aan ‘zelf’, en MS wordt dus ook wel getypeerd als een auto-immuun ziekte).
Dit immuun-proces zou zeer doeltreffend zijn tegen infecties. Bij auto-immuunziekten zoals MS zorgt het helaas voor hersenschade met de kenmerkende ziektesymptomen als gevolg.
De CSF-hersenbarrière
De 4 hersenventrikels die instaan voor de productie van het hersenvocht zijn zelf gevuld met CSF. Aan het oppervlak dat het CSF en de hersenen scheidt, kan opnieuw een barrière onderscheiden worden die bestaat uit één enkele laag van uitermate gespecialiseerde endotheelcellen. Deze barrière wordt de CSF-hersenbarrière genoemd. De endotheelcellen hier worden ook wel ependymcellen genoemd en hoewel deze gespecialiseerde endotheelcellen bijzondere eigenschappen hebben, vormt de ependymale cellaag geen volwaardige barrière gelijkaardig aan de andere hierboven besproken barrières. De ependymale cellen zijn slechts zwak verbonden met elkaar en bevatten verschillende gaten dat voor lekken zorgt. Door deze openingen kan CSF in en uit het hersenweefsel bewegen. Door deze ‘lekke’ eigenschap is het zeer belangrijk dat de samenstelling van het CSF zorgvuldig gereguleerd wordt. Dit laatste vindt plaats ter hoogte van de bloed-CSF barrière waar in contrast de epitheelcellen een echte strakke barrière vormen.
Wist je dat?
De CSF-hersenbarrière is de minst bestudeerde barrière van de hersenen, en dit terwijl het belangrijke functies vervult die bijdragen tot het behoud van een normale en gezonde hersenactiviteit. Zo hebben de ependymcellen gespecialiseerde structuren, namelijk de cilia. Cilia zijn kleine, haarfijne structuren die je kan vergelijken met je wimpers, maar dan nog een tiental keer kleiner. Ze beïnvloeden de bewegingsrichting van het CSF door hun kloppende bewegingen en filteren tegelijkertijd schadelijke stoffen uit het CSF.
De ependymcellen die deze CSF-hersenbarrière omlijnen zijn echter niet strak met elkaar verbonden, wat betekent dat het CSF gemakkelijk in en uit het hersenweefsel kan bewegen. Hierdoor kunnen voedingsstoffen en andere belangrijke stoffen de neuronen gemakkelijk bereiken. Recente studies laten zien dat ependymcellen ook een belangrijke functie vervullen bij beroertes. Bij deze aandoening fungeren de cellen als een soort van vervang spelers, vergelijkbaar met voetballers op de bank. Na een beroerte worden ze ‘op het veld’ geroepen en transformeren ze van ependymcellen naar neuronen waardoor ze de door de beroerte aangerichte schade proberen te verkleinen.
De barrières aan het oppervlak van de hersenen
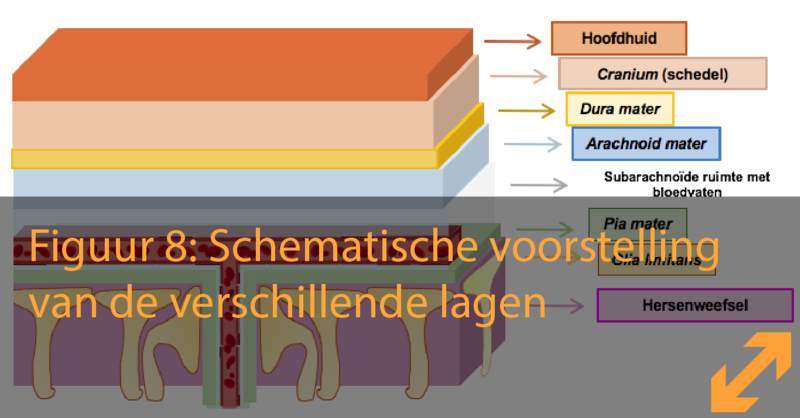
Gaande van de hoofdhuid naar de hersenen toe vormt de benige schedel een eerste bescherming van de hersenen tegen trauma’s. Onder de schedel en vooraleer de werkelijke hersenen bereikt worden, kunnen we de hersenvliezen onderscheiden, 3 lagen die de hersenen bedekken en beschermen (Figuur 7):
- Dura mater (Latijns voor ‘harde hersenvlies’), de buitenste laag die bedekt wordt door been en huid. Deze barre structuur beschermt de hersenen en houdt alles samen wanneer de schedel zou breken bij een ongeval.
- Arachnoid mater (Grieks voor ‘spinnenwebvlies’), de middelste laag en eerste echte barrière vooraleer de hersenen bereikt worden.
- Pia mater (Latijns voor ‘zachte hersenvlies’), de diepste laag van de hersenvliezen vooraleer de eerste hersencellen bereikt worden.
Tussen het spinnenwebvlies (arachnoidea) en het zachte hersenvlies (pia mater) is er een ruimte die de subarachnoïdale ruimte genoemd wordt. Deze ruimte is gevuld met CSF, dat ook weer als functie heeft om schokken op te vangen wanneer heel snelle bewegingen of hoofdtrauma’s plaatsvinden. De toegang van schadelijke stoffen via de hersenvliezen wordt gecontroleerd door de cellen van het spinnenwebvlies, die zeer sterk met elkaar verbonden zijn door tight junctions hetgeen opnieuw de hersenen isoleert, zoals bij de BBB.
Onder het zachte hersenvlies (pia mater) kan er een laag van astrocyten gevonden worden, namelijk de glia limitans. De cellen van de glia limitans hebben geen tight junctions, maar controleren toch de beweging van cellen en moleculen tussen de hersenen en het zachte hersenvlies.
Allen tezamen isoleren de verschillende hersenvliezen de hersenen van de rest van het lichaam, waardoor ze beschermd worden.
Wist je dat?
Heel vroeger werden de hersenvliezen ook wel ‘alumn al-dimagh’ genoemd door Arabische artsen. ‘Alumn al-dimagh’ kan vertaald worden als ‘moeder van de hersenen’ en deze term werd later vertaald in het Latijn als ‘mater’.
Hersenbarrières: Een dynamisch onderwerp
Hoewel reeds een eeuw geleden de verschillende hersenbarrières werden bestudeerd, tonen de voortdurende en verrassende ontdekkingen aan dat onze huidige kennis enkel het tipje van de ijsberg raakt! De huidige technische vooruitgang in biologisch onderzoek maakt het mogelijk om de verschillende eigenschappen, de cellulaire componenten en de dynamiek van de verschillende hersenbarrières te onderzoeken in een immers toenemend detail. De gezamenlijke inspanningen en het samenwerken en delen van data tussen wetenschappers op internationaal niveau gedurende de voorbije decennia hebben een cruciale bijdrage geleverd aan de wetenschappelijke vooruitgang in dit veld. We zijn bijvoorbeeld nu in staat om de volgende twee aanstormende onderwerpen te onderzoeken: het dynamisch karakter van de barrières en de complexe interactie tussen alle betrokken cellen.
De dynamische natuur van de hersenbarrières
In gezonde conditie zijn de hersenbarrières voortdurend actief om een zo constant mogelijke omgeving te regelen en behouden voor het CZS. Dit betekent echter niet dat de status quo van de hersenbarrières een vastgeroest, statisch geheel is. Integendeel, de barrières zijn zeer dynamisch en worden doorheen ons leven actief onderhouden, wat ook betekent dat ze zich aanpassen aan verschillende condities.
Dit aanpassingsvermogen wordt duidelijk in bepaalde condities waaraan elke persoon wel eens wordt blootgesteld. Onder bepaalde omstandigheden openen onze hersenbarrières als het ware, waardoor ze lichtjes lekkend worden. Dit gebeurt onder andere bij koorts, hoogteziekte of bij het beoefenen van extreme sporten. In deze omstandigheden ondervinden we een lichte hoofdpijn en/of verwarring, wat gedeeltelijk verklaard kan worden door een lekke hersenbarrière. Deze doorlaatbaarheid of hogere permeabiliteit benadrukt de dynamiek van de hersenbarrières en doet ons veronderstellen dat het soms, voor nog te ontdekken redenen, noodzakelijk is voor de barrières om meer dicht dan wel meer lek te zijn.
De neurovasculaire eenheid: Van samenwerkende cellen tot barrière
De verschillende cellen van de neurovasculaire eenheid (EC, pericyten en astrocyten) interageren en communiceren met elkaar om zo de eigenschappen van de barrière te reguleren.
Recente studies tonen dat pericyten essentieel zijn voor het transcellulair transport doorheen de BBB. De pericyten instrueren de EC namelijk om bepaalde BBB-specifieke transporter eigenschappen aan te nemen. De pericyten zijn als het ware de CEO’s van het logistieke BBB-bedrijf welke de aankomende en vertrekkende vrachtwagens coördineren ter hoogte van de EC. Veel onderzoek wordt nu uitgevoerd om onze kennis te verbeteren naar het gedrag van pericyten en hoe dit verschillende hersenziekten kan beïnvloeden.
Naast de pericyten, bepalen ook de astrocyten de integriteit van de EC door het coördineren van de vorming van tight junctions. Hoewel de ontdekking dat de astrocyten een belangrijke functie vervullen voor de integriteit van de EC al dateert van 1987, was het pas in 2011 dat wetenschappers het onderliggende molecule ontdekten dat door astrocyten uitgescheiden wordt en zo de EC coördineert om tight junctions te vormen.
Interessant genoeg helpen de pericyten de astrocyten ook in de zoektocht van hun zogenaamde eindvoetjes naar de bloedvaten om deze te omvatten. De nauwe onderlinge afhankelijkheid van deze cellen illustreert duidelijk de cruciale rol van communicatie tussen alle cellen om uiteindelijk een goed functionerende BBB te vormen.
Wat is BtRAIN
BtRAIN projecten
Wat is BtRAIN?
BtRAIN is een samenvoeging van het woord ‘brain’ of hersenen en ‘to train’ , trainen en opleiden. Onze missie is de verschillende aspecten van de hersenbarrières te onderzoeken van: van de vroege ontwikkeling, de werking en manipulatie tot het onderzoek naar ziekten waaronder de ziekte van Alzheimer, multiple sclerosis, hersenvliesontsteking en veroudering.
Hersenaandoeningen beïnvloeden wereldwijd het leven van meer dan een miljard mensen. Hiervan lijden ongeveer 300 miljoen mensen aan hersenaandoeningen zoals hersentumoren, multiple sclerose, beroertes, en de ziekte van Alzheimer en Parkinson. De verwachting is dat dit aantal slechts toeneemt als gevolg van de progressieve veroudering in onze samenleving. Huidige behandelingen zijn voornamelijk gericht op symptoombestrijding zonder de onderliggende ziekten een halt toe te roepen of te genezen. Ondanks een grote vooruitgang in onze kennis naar de ontwikkeling en werking van de hersenbarrières, ontbreekt er nog steeds cruciale kennis voor de ontwikkeling van behandelingen voor de genoemde aandoeningen geassocieerd met slecht functionerende hersenbarrières. De nood is dus hoog om nieuwe kennis op te doen over de manier waarop onze hersenen werken en hoe men vervolgens nieuwe en betere behandelingen kan ontwikkelen.
BtRAIN is ontstaan met als doelstelling het samenbrengen van wetenschappers binnen het vakgebied van hersenbarrières uit verschillende laboratoria van de Europese Unie. Het doel is om gezamelijk de functie van hersenbarrières te ontleden en nieuwe therapeutische interventies te ontwikkelen. Het netwerk van BtRAIN is een Europees Trainings Netwerk (European Training Network, ETN) onderdeel van de Marie-Sklodowska Curie acties (Marie-Sklodowska Curie Actions, MSCA). De MSCA verstrekken onderzoeksbeurzen ter ondersteuning van PhD studenten (early stage researchers, ESRs) in een netwerk van zowel academische als industriële partners. De ESRs krijgen de gelegenheid om middels samenwerkingsprojecten belangrijke kennis en ervaring op te doen in verschillende onderzoeks sectoren. Het BtRAIN netwerk bestaat uit 12 academische en niet-academische centra met hiernaast ook extern geassocieerde partners. Elk van de 12 organisaties ondersteunt telkens 1 project uitgevoerd door 1 ESR, welke allen middels samenwerking verbonden zijn. Meer informatie over de individuele projecten kan gevonden worden onder volgende link: http://btrain-2020.eu/esrOverview
Wij, de ESRs van BtRAIN!
The BtRAIN projects
ESR 1 – Marjolein Heymans
In vitro modellen van de BBB en farmaceutische en toxicologische toepassingen
In mijn individueel project test ik verschillende medicijnen, die de hersenen als einddoel hebben, in vitro. In vitro betekent letterlijk ‘in glas’ en wil zeggen dat er getest wordt in een ‘testbuis’. In vitro is het tegenovergestelde van in vivo, wat letterlijk betekent ‘in het levend organisme’ en betekent dat er getest wordt in een levend organisme.
Voor mijn studie naar de bloed-hersenbarrière (blood-brain barrier, BBB) maak ik gebruik van verschillende type menselijke (e.g. stamcellen) en dierlijke cellen, die wanneer ze samen gebruikt worden in 1 model, het mogelijk maken om de BBB na te bootsen. Het soort experimenten die ik in mijn studie gebruik, verminderen het uitgebreide gebruik van dieren, maar heeft nog altijd de mogelijkheid om de kenmerken van de BBB te bestuderen.
Het uiteindelijke doel van dit project is om de bestudeerde in vitro modellen te gebruiken in onderzoek naar de verspreiding van medicijnen in de hersenen en in onderzoek naar de neurotoxiciteit van medicijnen.
ESR 2 – Ana Raquel
In vitro modellen van de bloed-hersenbarrière en bloed-CSF barrière gebruikmakend van een geïntegreerd microfluïdisch apparaat
Bloedvaten vormen het onderdeel van onze bloedstroom dat ons bloed door ons lichaam transporteert. Twee belangrijke functies van de bloedvaten zijn enerzijds de scheiding van het bloed en de organen, maar tevens de verbinding van het bloed met de organen. De bloed-hersen barrière (BBB) is een selectieve barrière welke het circulerende bloed scheidt van de hersenen en de rest van het centraal zenuwstelsel. Doordat onze hersenen zo’n complex geheel vormen, is het een uitdaging om verschillende neurodegeneratieve ziekten te behandelen, waaronder de ziekte van Alzheimer en Parkinson en hersentumoren. Voor de studie van onze bloed-hersen barrière is het derhalve noodzakelijk om een goedkope en gemakkelijke manier om de bloed-hersenbarrière te onderzoeken door middel van een model. Zoals een vliegtuig model getest wordt in een windtunnel, kunnen de cellen van de BBB gekweekt worden in een goed ontworpen vloeistof kanaal. Met zo’n model kunnen fysiologische condities gesimuleerd en cruciale parameters van de cel gemeten worden.
Wat kunnen kunnen we met zo’n model nog doen? We kunnen bepaalde aandoeningen die gerelateerd zijn aan de bloed-hersenbarrière nabootsen. Door het moduleren van de hersenbarrières, met steeds betere technieken, kunnen we zo betere behandelingen ontwikkelen.
ESR 3 – Raoul F.V. Germano
Transcriptionele vergelijking van zebravis en muis brein-endotheelcellen en functionele ontleding van geconserveerde signaalpaden in brein vaatvorming en vorming van de bloed-hersenbarriere.
Ondanks de vitale rol van de bloed-hersenbarriere (BBB) voor adequate functie van de hersenen, ontbreekt gedetailleerde kennis over hoe de vorming van deze bloedvaten wordt geïnstrueerd. Om nieuwe genen te identificeren welke de ontwikkeling van de endotheliale barrière reguleren maken we gebruik van de zebravis. Dit diermodel geeft de gelegenheid om in levende embryo's de ontwikkeling van bloedvaten en de barrièrefunctie te visualiseren en manipuleren. Om essentiële genen voor de vorming van de hersenbarrière te vinden, kijken we naar de genen die actief zijn in de endotheelcellen van de BBB in zowel zebravissen als muis breinvaten. Het idee is dat we in de loop van evolutie als gewervelde diersoort veranderden van vis naar zoogdieren (onder zoogdieren verstaan we zowel mense als muis), waarbij de genen die fundamenteel zijn voor BBB-vorming zijn behouden in het process van natuurlijke selectie. Dit betekent dat de vergelijking van beide diersoorten ons de mogelijkheid verschaft om ‘kern’-genen te identificeren voor de regulatie van de verwerving van barrière-eigenschappen door endotheliale cellen. Vervolgens kunnen hieruit kandidaatgenen geselecteerd worden om deze verder te bestuderen. Beter begrip van de functie van deze kandidaatgenen zou onze kennis over hersenziekten vergroten, en verschaft de mogelijkheid voor de ontwikkeling van alternatieve strategieën voor de behandeling van patiënten lijdend aan deze aandoeningen.
ESR 4 – David M. F. Francisco
Geïntegreerde meta-analyse van publieke en nieuwe omica-data van de BBB van gewervelde dieren, en ontwikkeling van het BBBHub platform
Informatie is belangrijk. Hoewel, opdat informatie nuttig zou zijn moet het verstaanbaar en toegankelijk worden. De voornaamste doelstelling van mijn project is het vinden van manieren om informatie te verspreiden die we hebben over de genexpressie (transcriptoom) van de hersenbarrières. Hiervoor werk ik samen met de andere personen in het BtRAIN netwerk en analyseer ik genexpressie data welke zij produceren. Ik ontwikkel ook methodes om bestaande data te vergelijken zowel op basis van de resultaten als op basis van de kwaliteit. Het eindresultaat zal resulteren in een web platform waar alle informatie omtrent genexpressie in de hersenbarrières zal verzameld en geanalyseerd worden. Dit geeft wetenschappers in het veld een betere toegankelijkheid tot de datasets om deze te analyseren en vergelijken.
ESR 5 – Kakogiannos Nikolaos
De rol van de G-proteïne-gekoppelde receptor (Gpr126) signalisatie in de ontwikkeling van de bloed-hersenbarrière
De complexe structuur van de bloed-hersenbarrière (BBB) bemoeilijkt pogingen om medicijnen in de hersenen te krijgen in behandelingen voor verschillende pathologische condities, waaronder kanker en neurodegeneratieve aandoeningen. Om tot dit punt te komen, moeten we de dynamiek en moleculaire mechanismen achter de ontwikkeling van de BBB verstaan, en dit kunnen we doen door het identificeren van nieuwe genen. In ons labo leggen we de nadruk op een nieuw gen, Gpr126, waarvan we geloven dat het een belangrijke functie vervult in de ontwikkeling van de BBB. Hierbij proberen we de rol en het moleculaire mechanisme te onderzoeken dat Gpr126 vervult tijdens de ontwikkeling van de BBB.
ESR 6 – Eduardo Frías-Anaya
Ouderdom-geïnduceerde veranderingen in gen- en microRNA expressie in de bloed-hersenbarrière van de muis
We veranderen allemaal geurende veroudering. Het is een natuurlijk en niet te stoppen proces dat ons hele lichaam beïnvloed tezamen met zijn vele functies. Zoals alle andere organen ondergaan onze hersenen veroudering en dit brengt verschillende veranderingen teweeg op vlak van onze cognitie, ons geheugen of maakt het ons meer gevoelig aan neurodegeneratieve ziekten en aan vasculaire incidenten waaronder beroertes. Neurovasculaire voorvallen zijn sterk gerelateerd aan de bloed-hersen barrière (BBB) omdat de werking en structuur van deze barrière verandert tijdens veroudering. Zo verhoogt de doorlaatbaarheid van de BBB, wat een grotere passage als gevolg heeft van stoffen uit de bloedstroom naar de hersenen. Deze veranderingen op niveau van de BBB lijken gerelateerd te zijn met veranderingen in de genexpressie en miRNA (kleine moleculen die de expressie van verschillende genen stimuleren of blokkeren). In dit onderzoek trachten we na te gaan welke veranderlijke expressie, ter hoogte van de BBB, gerelateerd kan worden aan de structurele en functionele veranderingen die plaatsvinden bij veroudering.
ESR 7 – Ricardo M. Figueiredo
Niet-coderend RNA afkomstig van de BBB als functionele biomarkers voor de verouderende BBB versus de BBB de ziekte van Alzheimer
De ziekte van Alzheimer (Alzheimer’s disease, AD), met dementie als één van de meest heersende ziektebeelden bij ouderen, treft wereldwijd bijna 13.8 miljoen mensen. Hierdoor is het vinden van accurate en niet-invasieve diagnostische en prognostische methodes zeer dringend. Momenteel bestaat de preliminaire diagnose van AD uit een combinatie van klinische criteria waaronder een neurologisch onderzoek, mentale status en hersenbeeldvorming. Op basis van deze klinische testen is het echter moeilijk om AD vast te stellen bij patiënten in de vroege fases van AD. De barrière eigenschappen van de bloed-hersenbarrière (BBB) komen gewijzigd voor in de hersenen van AD patiënten, waardoor we verwachten dat de endotheelcellen een verschillende genexpressie kennen in zulke condities. Als gevolg hiervan kunnen kleine RNA moleculen vrijgelaten worden in het bloed van AD patiënten. Hiervoor zullen we sensitieve technieken ontwikkelen om het bloed te analyseren en om te zoeken naar kleine RNA moleculen die aan de basis liggen van een verstoorde BBB. Als de in het bloed gevonden kleine RNA moleculen dezelfde zijn als degene gevonden worden in de endotheelcellen van de verstoorde BBB, dan kunnen we deze moleculen als functionele biomarkers gebruiken voor deze conditie. Deze RNA moleculen kunnen in de toekomst dan gebruikt worden voor de diagnose van AD.
ESR 8 – Luca Marchetti
Mechanismen van hersen endotheelcellen ter sturing van de cellulaire signaalpaden in T-cel tijdens migratie doorheen de BBB
Het is de taak van de immuun cellen om ons te beschermen tegen infecties en externe stoffen. Bij auto-immuunziekten kunnen immuun cellen echter zelf schadelijk worden, door nog onbekende redenen, doordat ze ons eigen lichaam aanvallen. Multiple sclerose is een auto-immuunziekte van het centraal zenuwstelsel waarbij immuun cellen de BBB kunnen doorkruisen en schade toebrengen aan de hersenen. In mijn project proberen we de verschillen te achterhalen tussen de gebruikte mechanismen van 2 verschillende types immuun cellen, namelijk Th1 en Th17, om de BBB te doorkruisen. We weten dat T-cellen gebruik maken van 2 mogelijke pathways om de BBB te doorkruisen: ‘tussenin de celmembranen door’ en ‘doorheen de celmembranen’, welke bekend staan als de paracellulaire en transcellulaire pathway. In ons labo kunnen we de endotheelcellen van de BBB stimuleren op zo’n manier dat het T-cellen aanstuurt tot gebruik van de trans- of paracellulaire pathway afhankelijk van de voorkeur. Door het gebruik van een moderne techniek, namelijk RNA sequencing, hebben we een volledig zicht op welke genen actief zijn in de endotheelcellen van de BBB onder de verschillende condities. Ons doel is de identificatie van die genen die in staat zijn de T-cellen aan te sturen tot de trans- of paracellulaire pathway. Beide benaderingen kunnen ons helpen om tot een beter begrip te komen hoe T-cellen de BBB doorkruisen tijdens multiple sclerose. Door de identificatie van genen cruciaal in dit proces, trachten we de huidige behandelingen voor multiple sclerose te verbeteren door de specificiteit te verhogen en de neveneffecten te reduceren.
ESR 9 – Amaia Dominguez-Belloso
Bijdrage van de BBB in de β-amyloïd biologie in de ziekte van Alzheimer
β-Amyloïd (Aβ) is één van de 2 voornaamste moleculen die in de hersenen accumuleren bij patiënten van de ziekte van Alzheimer (Alzheimer’s disease, AD) en die leidt tot aantasting van de neuronen met bijgevolg het welbekende symptoom van de ziekte van Alzheimer: geheugenverlies. BACE-1 is het molecule dat Aβ produceert, en ons labo toonde eerder aan dat de endotheelcellen (ECs) van de hersenvaten de actieve vorm van deze BACE-1 bevat, wat mogelijks bijdraagt tot AD. Ons doel is om de rol van de ECs in AD te verstaan, en we hopen op deze manier nieuwe doelwitten, zoals BACE-1, te ontdekken die van belang kunnen zijn bij behandelingen van deze vreselijke ziekte, die een steeds stijgend deel van de westerse bevolking treft.
ESR 10 – Markus Schuster
Verkenning van CD4+ T-cellen als carriers voor het transport van medicijnen over de bloed-hersenbarrière
Ons doel is om een shuttle-systeem voor medicijnen te ontwikkelen dat kan gebruikt worden om medicijnen gemakkelijker te transporteren van het bloed naar de hersenen. Om tot dit punt te komen, worden medicijnen ingekapseld in kleine polymere nano-capsules die ook wel polymeersomen genoemd worden en bestaan uit biocompatibele en biodegradeerbare polymeren. Om deze polymeersomen te bezorgen in de hersenen, overheen de BBB, worden de polymeersomen vastgehecht aan T-cellen, die over het inherente vermogen beschikken om de BBB te doorkruisen en ook natuurlijk voorkomen in het hersenweefsel. Nadat de T-cellen de polymeersomen tot hun finale doelwit hebben gebracht, degraderen de polymeersomen totdat ze loskomen van de cellen en hun cargo vrijlaten.
ESR 11 – Marie Wiatr
De rol van verschillende receptoren in de stimulatie van migratie van pathogenen en leukocyten over de BCSFB in hersenvliesontsteking
In mijn project bestudeer ik hoe een virus in de hersenen terecht komt en hoe het dus de hersenbarrières kan doorkruisen. Ik werk met een specifiek virus dat hersenvliesontsteking kan veroorzaken, namelijk echovirus 30. Dit type virus kan de hersenbarrière verstoren, hetgeen kan leiden tot hersenschade. Hierbij probeer ik te identificeren hoe het virus in de epitheelcellen van de hersenbarrière geraakt en meer specifiek aan de hand van welke mechanismen en door hechting aan welke moleculen het in de cellen kan penetreren.
Wanneer je ziek bent, vechten je immuun cellen tegen de pathogenen. Een ander deel van mijn werk bestaat eruit na te gaan hoe deze immuun cellen de hersenen binnenkomen als gevolg van een infectie.
ESR 12 – Sabela Rodríguez Lorenzo
Moleculaire controle van de hersenbarrières bij de mens in gezonde conditie en neuro-inflammatie
Om de delicate omgeving van de hersenen te behouden, wordt het hersenvocht of de cerebrospinale vloeistof (cerebrospinal fluid, CSF) waarin de hersenen baden, gescheiden van het bloed door de bloed-CSF barrière ter hoogte van de plexus choroideus. Deze barrière is een belangrijke spilfiguur die controleert welke stoffen doorgelaten worden en die zo verschillende schadelijke componenten tegenhoudt. In multiple sclerosis (MS) kunnen de cellen van het immuunsysteem, die in normale omstandigheden het lichaam beschermen tegen externe bedreigingen, zich in de hersenen bewegen. Hier vallen ze de lichaamseigen myelineschede aan die instaat voor de isolatie van de neuronen. In dit onderzoek trachten we te verstaan wat er fout loopt bij patiënten met MS ter hoogte van de bloed-CSF barrière. We gebruiken een techniek, namelijk RNA sequencing, die het mogelijk maakt om het genetische profiel van de plexus choroideus te vergelijken tussen gezonde en MS-patiënten. Via dit profiel kunnen we nagaan welke genen er veranderlijk voorkomen bij MS patiënten, hetgeen ons een idee kan geven welke mechanismen van de bloed-CSF barrière een belangrijke invloed hebben in dit ziektebeeld. Deze informatie kan ons in de toekomst hopelijk helpen voor de ontwikkeling van aangepaste medicatie ter behandeling van MS.
Videos
BBB gerelateerde